Sleep disorder, a potential early diagnostic marker for psychiatric and neurodegenerative diseases PDF
Preview Sleep disorder, a potential early diagnostic marker for psychiatric and neurodegenerative diseases
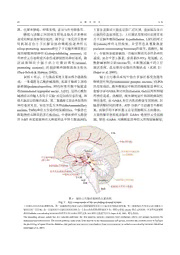
动 物 学 研 究 2011,Feb. 32(1): 81−90 CN 53-1040/Q ISSN 0254-5853 Zoological Research DOI:10.3724/SP.J.1141.2011.01081 非人灵长类动物模型睡眠研究在神经精神疾病的 早期诊断和药效评价中的作用 陈艳梅1 , 秦冬冬1,4, 姜慧慧1,4, 胡新天1,2,3,*, 马原野1,2,3,* (1. 中国科学院昆明动物研究所, 云南 昆明 650223; 2. 中国科学院生物物理研究所 脑与认知国家重点实验室, 北京 100101; 3. 中国科学院生物物理研究所, 北京 100101; 4. 中国科学院研究生院, 北京 100049) 摘要:清醒−睡眠的周期性调节需要众多单胺类神经递质(5-HT、NE、DA 等)、乙酰胆碱等兴奋性神经递质 以及GABA等抑制性神经递质的参与。这些递质系统的异常不仅会导致睡眠周期紊乱, 还与一系列的精神性和神 经退行性疾病相关。睡眠异常被认为是抑郁症、帕金森氏病等神经系统疾病发生的早期预警信号。相比起低等哺 乳动物, 非人灵长类动物的睡眠与人类的睡眠具有更好的可比性。近来, 利用非人灵长类动物来建立神经精神疾 病模型的研究已取得明显进展。在建模的同时监测动物的睡眠状况, 有助于我们进一步了解睡眠在这些疾病早期 诊断和发展过程中的作用, 为疾病的早期诊断、治疗和药效评价提供更好的客观依据。 关键词:睡眠; 非人灵长类; 神经精神疾病; 疾病模型; 早期诊断; 药效评价 中图分类号:R-332;R749; R338.64; Q 959.848 文献标志码:A 文章编号:0254-5853-(2011)01-0081-10 Sleep disorder, a potential early diagnostic marker for psychiatric and neurodegenerative diseases CHEN Yan-Mei1, QIN Dong-Dong1,4, JIANG Hui-Hui1,4, HU Xin-Tian1, 2, 3,*, MA Yuan-Ye1, 2, 3,* (1. Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming Yunnan 650223, China; 2. State Key Laboratory of Brain and Cognitive Science, Institute of Biophysics, the Chinese Academy of Science, Beijing 100101, China; 3. Institute of Biophysics, the Chinese Academy of Sciences, Beijing 100101, China; 4. Graduate University of the Chinese Academy of Sciences, Beijing 100049, China) Abstract: Sleep/circadian timing depends on several neurotransmitter systems, including 5-HT, NE, DA, Ach, GABA, etc. These neurotransmitter systems play critical roles in mental, emotional and cognitive functions in the brain. Dysfunctions of these systems not only result in sleep disorder, but are also related to many psychiatric and neurodegenerative diseases. Sleep disruption is tightly associated with an increased susceptibility to a broad range of psychiatric and neurodegenerative diseases, such as depression and Parkinson diseases. Non-human primates, especially the rhesus monkey is an excellent biomedical model for human sleep and CNS diseases. Establishing nonhuman primates’ model of mental disorders and monitoring the sleep changes during the development of the model will help us to know more about the relationships between sleep disorder and psychiatric and neurodegenerative diseases. Sleep disorder as an early marker for psychiatric and neurodegenerative diseases would permit early intervention of these diseases and draw attention to the potential therapeutic benefits of normalizing sleep rhythms in individuals with brain pathologies. Key words: Sleep; Non-human primates; Psychiatric/neurodegenerative disorder; Early disease diagnoses; Disease model; Drug efficacy test 1 睡眠调节的脑结构及相关的神经递质 求。睡眠与清醒是两个截然不同的生存状态, 相对 于意识清醒时刻, 睡眠时机体对外界的反应较差, 睡眠是人类和大部分动物必不可少的生理需 嗅觉、视觉、听觉、触觉等感觉减退, 以及体温下 收稿日期:2010-12-15; 接受日期:2011-01-06 基金项目:中国科学院知识创新工程重要方向项目(KSCX2-EW-R-11);中国科学院基础前沿研究专项项目(KSCX2-EW-J-23)资助 ∗通讯作者(Corresponding authors), E-mail: [email protected]; [email protected] 第一作者简介:陈艳梅, 女, 中国科学院昆明动物研究所08级博士, 专业方向为神经生物学, E-mail:[email protected] 82 动 物 学 研 究 32卷 降、代谢率降低、呼吸变慢, 意识与外界隔离等。 主要负责激活大脑皮层的广泛区域, 进而提高来自 睡眠与清醒之间的相互转化是脑内许多神经 丘脑的信息处理能力。上行激活系统同时还接受来 递质的释放或抑制引起的, 调节这一变化的主要神 自下丘脑外侧部(lateral hypothalamus, LHT)的阿立 经机制是位于下丘脑前部的睡眠促进神经元 新(orexin)神经元的投射, 并受黑色素聚集激素 (sleep-promoting neurons)和位于下丘脑外侧部和后 (melanin-concentrating hormone)的调节。清醒时, 脑 部的睡眠抑制神经元(sleep-inhibiting neurons), 这 干、中脑和基底前脑的一些脑区释放兴奋性的神经 些神经元分别释放兴奋性或抑制性的神经递质, 激 递质, 如去甲肾上腺素, 血清素(5-HT), 组氨酸, 乙 活或抑制位于脑干的上行激活系统(arousal- 酰胆碱和阿立新(orexin)等, 不断激活脑干的上行 promoting systems), 控制清醒和睡眠的相互转化 激活系统, 进而维持动物的清醒状态(见图 2) (Pace-Schott & Hobson, 2002)。 (Saper et al, 2005)。 如图 1 所示, 上行激活系统主要由两个通路构 脑干上行激活系统中的许多脑区都受到腹外 成:一条通路为乙酰胆碱通路, 起源于脑桥上部的 侧视前叶核团(ventrolateral preoptic nucleus, VLPO) 脑桥脚(pedunculopontine, PPT)和背外侧中脑被盖 的直接调控, 腹外侧视前叶核团的睡眠促进神经元 核(laterodorsal tegmental nuclei , LDT), 这些乙酰胆 能够分泌GABA和甘丙肽(Galanin, Gal)这两种抑制 碱神经元的输入有助于丘脑−皮层间的信息传递, 维 性神经递质。清醒时, 腹外侧视前叶核团的抑制性 持大脑皮层的激活状态。第二条通路主要由单胺类的 神经递质, 如 GABA 和甘丙肽的释放受到抑制, 但 神经递质负责, 如结节乳头体核(tuberomammillary 随着清醒时间的增多, ATP 分解产生的腺苷不断积 nucleus, TMN)神经元分泌的组氨酸(His), 中脑多巴 累, 而腺苷的不断积累又会导致睡眠压力的增加。 胺能神经元释放的多巴胺(DA), 中缝核神经元释放 大量的腺苷使基底前脑的 GABA 能神经元受到抑 的5-HT和蓝斑核神经元释放的去甲肾上腺素(NE), 制, 使得 GABA 对睡眠促进神经元的抑制被解除, 图1 脑内上行激活系统的主要结构 Fig. 1 Key components of the ascending arousal system 上行激活系统由两条通路构成:第一条通路(黄色线表示)的乙酰胆碱系统有助于丘脑-皮层间的信息传递; 第二条通路(红色线表示)负责激活大 脑皮层的广泛区域, 进一步提高来自丘脑信息的处理能力, 主要由单胺类的神经递质介导, 同时还接受 orexin 神经元的投射, 并受黑色素聚集 激素(melanin-concentrating hormone)的调节以及GABA神经元和Ach神经元的调节(引自Saper et al, 2005, 略有改动)。 The ascending arousal system has two separate pathways: the first pathway (yellow) originates from cholinergic (ACh) cell groups, facilitates the thalamocortical transmission. The second pathway (red) arises from neurons in the monoaminergic cell groups, activates the cerebral cortex to facilitate the processing of inputs from the thalamus, this pathway also receives contributions from orexin neurons or melanin-concentrating hormone (Modified from Saper et al, 2005). 1期 陈艳梅等:非人灵长类动物模型睡眠研究在神经精神疾病的早期诊断和药效评价中的作用 83 图2 腹外侧视前叶核团的睡眠促进神经元对上行激活系统的投射 Fig. 2 Key projections of sleep-promoting neurons of the ventrolateral preoptic nucleus (VLPO) to the main components of the ascending arousal system 腹外侧视前叶核团(VLPO)的睡眠促进神经元释放GABA和甘丙肽这两种抑制性神经递质, 这些递质直接作用于上行激活系统中的许多主要脑 区, 使得上行激活系统全面失活, 动物进入睡眠状态(引自Saper et al, 2005, 略有改动)。 The release of inhibitory neurotransmitters GABA and galanin from sleep-promoting neurons in the ventrolateral preoptic nucleus (VLPO) inhibit the key components of the ascending arousal system. With the inactivation of the ascending arousal system, animals drift off to sleep (Modified from Saper et al, 2005). 于是位于腹外侧视前叶核团的睡眠促进神经元便 在NREM 睡眠和REM 睡眠过程中, 脑内释放不同 大量释放GABA和甘丙肽。这些递质直接作用于上 种类的神经递质。NREM 睡眠时, 脑内所有单胺能 行激活系统中的主要组成部分, 如组胺酸(His)神经 和胆碱能神经递质及orexin的释放都被腹外侧视前 元、多巴胺(DA)神经元、5-HT 神经元以及蓝斑核 叶核团释放的GABA和甘丙肽所抑制。因此, 出现 的去甲肾上腺素(NE)神经元等。这些递质还会抑制 动物唤起度下降的现象。一旦NREM睡眠开始, 就 脑桥脚(pedunculopontine , PPT)和背外侧中脑被盖 可以在下丘脑−皮层之间的脑电EEG中记录到θ和 核(laterodorsal tegmental nuclei , LDT)的乙酰胆碱 δ 振荡, 以及睡眠纺锤波。而REM睡眠时, 虽然脑 神经元活动, 使得位于脑干、中脑和基底前脑的上 干内单胺类神经递质的释放同样被抑制, 但在 行激活系统全面失活, 动物进入睡眠状态(Saper et REM睡眠中, 起源于脑干、中脑和基底前脑的乙酰 al, 2005)。 胆碱神经元却会释放出乙酰胆碱神经递质, 脑内乙 正常情况下, 成年人完整的睡眠由一系列持续 酰胆碱的含量在REM睡眠时最多, 清醒时次之, 而 时间大约为 90 分钟的睡眠周期组成。每个周期由 NREM睡眠时最低(Vazquez & Baghdoyan, 2001)。 非快速眼动睡眠(non-rapid eye movement sleep, REM 睡眠的产生及调节被认为与乙酰胆碱神经元 NREM sleep)和快速眼动睡眠(rapid eye movement 的活动有关, 刺激脑桥部的胆碱能神经核团可诱发 sleep, REM sleep)组成。进入睡眠状态后, 首先是 PGO 棘波、肌肉弛缓和丘脑一皮质激醒(Hobson, NREM睡眠, 持续约60~90 min后进入REM睡眠, 1992)。 20~30 min后又转入NREM睡眠; 整个睡眠过程中, 总之, 睡眠的调节与脑干、中脑和基底前脑等 NREM和-REM睡眠约有4~5次交替(Sakurai et al, 脑区的上行激活系统有关, 上行激活系统内存在各 2010)。睡眠前期以慢波睡眠为主, 越到睡眠的后期, 种单胺类的神经递质和乙酰胆碱等兴奋性神经递 REM睡眠的时间越长 (Diekelmann & Born, 2010)。 质, 也有GAGA和甘丙肽等抑制性神经递质, 这些 84 动 物 学 研 究 32卷 递质的此消彼长, 促进了清醒和睡眠之间的相互转 3 年内患上抑郁症的风险大于非失眠患者, 失眠是 化, 一旦与上行激活系统相关的脑区发生病变或这 抑郁症出现的早期预警因子, 通过对失眠的早期治 些相关的神经递质释放出现异常, 就会出现睡眠周 疗有可能会阻止后期抑郁症的发展(Riemann & 期的紊乱, 出现睡眠问题, 如入睡困难、睡眠状态 Voderholzer, 2003)。 难以维持、REM 睡眠潜伏期变化、REM 睡眠行为 快速眼动(rapid-eye-movement, REM)睡眠行为 异常、REM-NREM睡眠周期紊乱等。 异常(sleep behaviour disorder, RBD)是在REM睡眠 状态下出现的行为异常, 如大声叫喊、拳打脚踢、 2 睡眠异常是精神性疾病和神经退行性疾 滚下床等。正常情况下, REM睡眠时人的运动机能 病发生的早期预警因子 降低、肌肉几乎完全松弛, 而REM睡眠行为异常的 通常情况下, 睡眠障碍, 如失眠一般伴随着疾 患者在 REM 睡眠时运动机能没有得到有效降低, 病的发生而发生, 其本身并不被认为是一种疾病。 于是在经历不愉快的梦境时, 梦中出现的行为便会 人们普遍认为,焦虑和抑郁症患者通常出现的失眠 表现出来。REM睡眠行为异常不仅会造成患者身体 只要在相关的疾病得到有效治疗后, 睡眠便会恢复 上的伤害, 严重时还危及生命(MD & MD, 2002)。 正常。然而, 越来越多的研究认为, 失眠本身就是 REM 睡眠行为异常的发生有可能是先天性的, 也 一种原发性疾病, 当他与精神性疾病同时出现时, 有可能与一些神经退行性疾病, 如帕金森、路易小 应被视为一种并发症。这主要是基于以下几种发现 体痴呆以及多器官萎缩有关(Postuma et al, 2006)。 (Pigeon et al, 2008):第一, 周期性抑郁症患者在抑 在先天性的 REM 睡眠行为异常中, 患者在清醒时 郁症状出现前均表现出失眠症状加重, 提示失眠有 没有运动及认知方面的障碍; 而在神经退行性疾病 可能是抑郁出现的前驱征兆; 第二, 治疗抑郁症的 的 REM 睡眠行为异常中, 患者运动和认知障碍出 临床用药并不能有效改善病人的睡眠状况; 第三, 现之前的许多年便会出现 REM 睡眠行为异常。有 抑郁症的认知疗法对睡眠障碍治愈效果不佳; 第四, 研究认为, 先天具有 REM 睡眠行为异常的人在之 精神性疾病是阶段性的, 而睡眠障碍则是慢性的, 后的岁月中患上某种神经退行性疾病的可能性更 即使是在精神疾病发病的潜伏期, 失眠也会不断出 大, 在一项研究中, 研究者发现, 在 29 位年龄大于 现; 第五, 治疗失眠的药物与治疗抑郁的药物, 如 50 岁, 先前被诊断出具有 REM 睡眠行为异常的患 氟西汀共同使用时, 对抑郁症的疗效显著高于单纯 者中, 38%的患者在之后的(3.7±1.4)年里被诊断出 的氟西汀治疗, 说明在治疗抑郁症的同时, 对睡眠 患有帕金森氏病, 另外有 7%的人在之后被诊断出 障碍进行治疗有助于抑郁症的痊愈; 第六, 越来越 患有其他类型的神经系统疾病(Schenck et al, 多的证据表明, 失眠患者在之后的 6 个月至 3 年内 1996)。在另一项研究中, 研究者经过长时间的跟踪 患上抑郁症的风险高于正常人。因此, 睡眠障碍不 研究, 发现在44位已经被诊断为REM睡眠行为异 仅导致了睡眠障碍者烦恼于入睡困难、入睡后极易 常的平均年龄为 74 岁的老年人中, 有 45%的患者 觉醒, 以及在不正确的时间里昏昏欲睡等睡眠问题, 在REM睡眠行为异常首次出现之后的11.5年后发 更严重的是, 睡眠障碍患者相比起正常人来说, 可 展出了不同性质的神经退行性疾病, 在明确诊断出 能更容易陷入一系列心理疾病及生理疾病的威胁 RBD之后, 发病时间一般为之后的5.1年(Iranzo et 中。 al, 2006)。这些研究都说明REM睡眠行为异常是帕 睡眠障碍, 如失眠是焦虑和抑郁症发展过程中 金森氏病等神经退行性疾病出现的先驱症状, 在医 的一个危险因子(Vollrath et al, 1989)。失眠既有可能 院的睡眠中心检测到 REM 睡眠行为异常的患者患 是疾病、药物、酒精等因素引发的继发性反应, 也 上更严重疾病的可能性要高于 REM 睡眠正常的患 有可能是精神、心理的高唤起度引发的原发性反 者, 通过在 RBD 出现的早期进行适当的治疗有可 应。在一项对青少年(12~18 岁)的研究中发现, 大 能对这些疾病的治疗提供新的有效手段。 约9.4%的人有睡眠障碍, 主要与饮酒、吸食大麻或 睡眠异常不仅可以作为疾病发生的早期预警 大麻以外的药物、抑郁等有关, 他们在成年早期 因子, 在疾病的发展过程中, 睡眠周期紊乱会进一 (18~25 岁)患上抑郁症的概率要高于正常人(Chang 步影响到神经元和神经内分泌的正常功能, 损伤人 et al, 1997)。另外一项研究同样发现, 失眠患者1~ 的认知、情绪调节等功能, 睡眠障碍会导致机体出 1期 陈艳梅等:非人灵长类动物模型睡眠研究在神经精神疾病的早期诊断和药效评价中的作用 85 现一系列不同于正常人的症状, 如代谢失常、免疫 理改变都是脑内神经递质信息传递的失常, 如抑郁 力低下、患癌症或心脑血管疾病的风险增加等 症与脑内 5-HT 水平低下有关, 帕金森病患者的多 (Wulff et al, 2010)。此外, 睡眠周期紊乱还会影响到 巴胺神经元出现异常等。目前用于治疗这类疾病的 人的正常社会活动。睡眠周期紊乱的患者作息时间 药物也主要是基于校正这些神经递质的异常分泌。 与常人不同, 其社会行为会发生相应的变化, 患者 从上一部分对睡眠调节的总结我们可以看出, 睡眠 不规律的睡眠还会使其接受正常光照刺激的几率 周期的调节需要众多单胺类、乙酰胆碱、GABA等 降低, 这些都将导致睡眠周期调节的进一步失衡, 神经递质的正常工作, 可以说, 睡眠调节与心理、 使得脑内本来已经失常的递质释放系统进一步紊 情绪、认知等方面的调节具有共同的物质基础 乱, 机体内部的各类激素和行为节律失去同步性。 (Wulff et al, 2010)。 除此之外, 药物治疗、成瘾药物的摄入和药物滥用 研究发现, 一系列的精神疾病和神经退行性疾 同样会影响到患者脑内正常的神经递质释放, 进一 病都伴随着睡眠周期的紊乱, 如睡眠时间与睡眠时 步损坏神经元和神经内分泌的调控, 睡眠周期进一 相的改变等(表 1)。在超过 80%的抑郁症和精神分 步失衡。因此, 对具有睡眠异常的精神性疾病和神 裂症患者中都会出现睡眠障碍, 阿尔兹海默病和帕 经退行性疾病患者进行提高睡眠质量的治疗, 将有 金森病等神经退行性疾病患者中也会出现睡眠周 助于疾病的更好治疗。 期的紊乱。事实上, 很多对精神性疾病的诊断标准 中都包括睡眠行为的变化, 如美国精神病学会编制 3 睡眠障碍与精神疾病和神经退行性疾病 的《精神疾病诊断与统计手册》(DSM-Ⅳ)和世界卫 研究实例 生组织编写的《国际疾病分类》等。 许多精神性疾病和神经退行性疾病的核心病 表1 各种精神性及神经退行性疾病的睡眠改变 Tab. 1 Sleep changes in psychiatric and neurodegenerative diseases 疾病名称 抑郁症 精神分裂症 阿尔兹海默病 帕金森氏病 Disease Depression Schizophrenia Alzheimer’s disease Parkinson disease REM睡眠潜伏期下降 慢波睡眠缺失 夜间清醒 失眠 首次REM睡眠时间增长 REM睡眠潜伏期下降 K-复合波及纺锤波异常 睡眠异常的表现 REM睡眠行为异常 REM睡眠中眼动减少 REM睡眠反弹缺失 REM睡眠及清醒时脑电β波减少 Sleep disorder REM/NREM睡眠失常 慢波睡眠减少 清醒−睡眠周期节律紊乱 慢波睡眠减少 白天睡眠增多 皮质醇浓度异常 睡眠纺锤波减少 白天睡眠增多 参考文献 (Berger & Riemann, 1993; Sabo & (Cohrs, 2008; (Wulff et al, 2010; (Arnulf et al, 2008; References Reynolds, 1991; Sitaram et al, 1982) Ferrarelli et al, 2007) Vitiello et al, 1990) Iranzo et al, 2006) 3.1 重度抑郁症(major depressive disorder, MDD) 而没有自杀行为的抑郁症患者第二阶段 REM 睡眠 患者的睡眠异常 时间较少, 深度睡眠较多, 说明睡眠紊乱的程度与 超过90%的重度抑郁症患者会出现睡眠障碍。 抑郁症的严重程度有一定相关性(Sabo & Reynolds, 对抑郁症患者的睡眠研究发现, REM睡眠异常与抑 1991)。 郁症的发生有关(Sitaram et al, 1982), 抑郁症患者 失眠也是抑郁症发病的前期危险因子(risk 第二阶段的 REM 睡眠比正常人多。睡眠异常可以 factor), 失眠患者在患病后1~3年时间内患上抑郁 作为抑郁症早期诊断的一个指标, REM睡眠潜伏期 症的可能性比睡眠正常的人要高(Riemann & 减少, REM睡眠密度增加以及REM睡眠增多有可 Voderholzer, 2003; Cole & Dendukuri, 2003)。不仅如 能是抑郁症发病的早期预警信号(Berger & Riemann, 此, 失眠还会进一步加重抑郁症患者的病情, 使患 1993)。另外, 在抑郁症患者中, 有过自杀行为的抑 者发展出新的抑郁症状。在抑郁症的治疗过程中, 郁症患者睡眠潜伏期更长, 睡眠效率更低, 睡眠过 失眠患者得到有效治疗的几率更低, 失眠患者经过 程中的深度睡眠更少(睡眠δ波的出现次数减少), 一般治疗后仍保持抑郁症状的几率是非失眠患者 86 动 物 学 研 究 32卷 的1.8~3.5倍(Pigeon et al, 2008), 说明睡眠障碍会 性发病过程会从多个方面影响到睡眠调节有关的 阻碍抑郁症的正常治疗。 脑区, 睡眠异常被看作是该病早期发展过程中的标 对睡眠周期的调节有利于抑郁症的康复和治 志性反应(Jeong, 2004)。下丘脑前部的腹外侧视前 疗。一些抗抑郁药的疗效被认为与其对睡眠的调节 叶核团(VLPO)和视交叉上核、下丘脑外侧部和下丘 作用有关。治疗抑郁症的一些三环类或非三环类抗 脑后部以及基底前脑都是睡眠周期调节的重要脑 抑郁药, 如丙咪嗪、阿米替林等都具有镇静效果, 区, 而 AD 患者的这些脑区都会出现神经退行性变 在催眠实验中被用作催眠药物。催眠剂(如唑吡坦) 化, 尤其是视交叉上核, AD患者的神经病理学症状 或褪黑素激动剂等药物能提高使用者的睡眠质量, 显著高于同年龄的正常人(Hoogendijk et al, 1997)。 使人的入睡潜伏期下降, 睡眠稳定性升高等, 这些 由于AD患者基底前脑和VLPO脑区的损伤, VLPO 药物同时也能够改善失眠者和抑郁症患者的睡眠 对脑干上行网状激活系统的抑制不能正常发生, 导 问题, 对提高使用者的心境状况有利。在一些对传 致AD患者慢波睡眠减少和NREM睡眠1期增加。 统抗抑郁药不敏感的患者身上使用能够促进清醒 除此之外, AD患者NREM睡眠2期的特征脑电波, 状态的药物莫达非尼, 调整患者的睡眠周期节律, 如K-复合波、纺锤波几乎不会形成, 即使是形成了 可以减轻患者的抑郁症状, 对提高抑郁患者的生存 其幅度也很小, 持续时间较短, 数量较少(Wulff et 质量有益(Asnis et al, 1999)。 al, 2010)。此外, 在AD出现的早期便会出现基底前 3.2 精神分裂症患者的睡眠异常 脑乙酰胆碱神经元的变性, 而基底前脑乙酰胆碱神 精神分裂症患者的睡眠障碍早在20世纪20年 经元向皮层的投射被认为是 REM 睡眠过程中大脑 代就被研究报道了。30%~80%的精神分裂症患者 皮层兴奋的主要原因, 乙酰胆碱神经元的损伤被认 都有睡眠不同程度的睡眠问题。睡眠质量越差, 患 为是AD患者REM睡眠紊乱的重要原因(Vitiello et 者的生存质量越低。在精神分裂症患者中, REM睡 al, 1990)。 眠的潜伏期减少, REM睡眠密度、睡眠有效性、睡 3.4 帕金森病患者的睡眠异常 眠总时间以及NREM睡眠4期的时间都减少(Cohrs, 帕金森患者的中脑“黑质”神经元出现路易小 2008)。精神分裂症患者 NREM 睡眠中的睡眠纺锤 体(Lewy body)沉积, 导致该区域神经元细胞的死 波数量、幅度、持续时间以及整体性都下降 亡, 进一步导致纹状体部位的多巴胺神经元变性, (Ferrarelli et al, 2007)。精神分裂症患者睡眠质量的 多巴胺合成减少, 抑制乙酰胆碱的功能降低, 两者 提高与负性症状的减轻相关。 失衡的结果使患者出现了“震颤麻痹”, 不仅如此, 精神分裂症患者的睡眠异常与其脑部结构及 多巴胺、乙酰胆碱等神经递质释放的紊乱还会破坏 神经生理学上的广泛病变有关。Hendler et al (2009) 正常的睡眠周期调节。帕金森病患者经常会出现夜 研究表明, 精神分裂症患者脑内与GABA有关的抑 间睡眠障碍及白天昏昏欲睡的现象, 约有 80%~ 制性神经通路功能失常, 皮质醇浓度也普遍高于正 90%的 PD 患者会出现入睡困难, 睡眠状态难以保 常人。此外, 精神分裂症患者皮层神经纤维网减少, 持等现象。然而, Lewy小体沉积不止是在黑质发生, 海马神经元数量降低, 在儿童时期便会出现皮层灰 在脑干的核团中也会出现 Lewy 小体沉积, 这些核 质的萎缩。 团的退行性变化会从根本上破坏 REM 睡眠和 与精神分裂症有关的基因中有好几种都与睡 NREM睡眠的结构。研究表明, REM睡眠的异常在 眠周期节律调节有关, 如 DISC1 (disrupted in PD 症状出现之前好多年便会出现(Arnulf et al, schizophrenia 1) 基 因 和 PDE4D (cyclic AMP 2008), 该研究提示我们, REM睡眠有可能是PD疾 (cAMP)-specific 3′,5′-cyclic phosphodiesterase 4D)基 病的早期症状, 为该病的早期诊断提供了依据。在 因等。 DISC1 基因的异常与动物的快感缺乏和睡 PD治疗方面, 研究表明, 调节睡眠周期节律的褪黑 眠调节紊乱有关 (Sawamura et al, 2008); 而PDE4D 素和光照疗法能显著提高PD患者的睡眠质量。 多态性变化与失眠有关, 并且与精神分裂症的发病 总之, 当神经退行性疾病导致的脑损伤涉及到 有关(Tomppo et al, 2009)。 与睡眠调节有关的脑区和睡眠调控的神经递质时, 3.3 老年痴呆患者的睡眠异常 睡眠异常便会产生。对神经退行性疾病患者的睡眠 阿尔兹海默病(Alzheimer’s disease, AD)的退行 障碍进行治疗或许能缓解疾病的症状, 延缓疾病的 1期 陈艳梅等:非人灵长类动物模型睡眠研究在神经精神疾病的早期诊断和药效评价中的作用 87 发展进程, 进一步提高患者的整体生存质量。 饲养方面的简易性, 猕猴已经成为比较生物学研究 的最好的模式生物 (Balzamo et al, 1977; Deadwyler 4 非人灵长类动物的睡眠研究 et al, 2007)。 睡眠研究早在 20 世纪 20~30 年代就得到研究 与黑猩猩和人类相似, 猕猴的睡眠模式与低等 者的广泛关注, 早期的睡眠研究主要以人或猫作为 哺乳动物差别很大(Weitzman et al, 1965)。在猕猴的 动物模型来进行。随着研究不断深入, 研究者发现, 睡眠过程中, 睡眠的各种特征脑电波可以被很轻易 低等哺乳动物, 如猫的睡眠与人类存在许多不同的 地区分出来。此外, 猕猴的睡眠也会出现与人类睡 地方, 其中的一个重要差别就是猫通常只有两个睡 眠中相似的周期性脑电变化, 在整夜的睡眠中, 猕 眠时相, 即包含睡眠纺锤波的慢波睡眠和异相睡眠, 猴睡眠在清醒—NREM 睡眠—REM 睡眠的交替中 而人类的睡眠通常可以被明显地分为很多个时相, 进行。在对猕猴进行的每天的睡眠监测中发现, 即NREM睡眠1期、2期, 慢波睡眠 (NREM睡眠 REM睡眠占总睡眠的15%, 每次REM睡眠持续约 3、4 期)和异相睡眠。低等哺乳动物的睡眠和人类 6 min 每51分钟出现一次, 人类中, 这个周期的间 的睡眠差别的另外一个方面是, 在猫和大鼠睡眠过 隔时间大约 90 min, 而在大鼠中, 这个间隔时间仅 程中, 通常可以在海马处记录到明显的 theta 波, 而 为13 min。与人类睡眠相似, 猕猴睡眠过程中海马 在人类睡眠中没有这种特征波(Cantero et al, 2003)。 处也不能记录到明显的theta波 (Kripke et al, 1968; 对非人灵长类(non-human primates)动物的研究 Hsieh et al, 2008)。 为睡眠研究提供了一个更好的研究模式。研究表明, 在最近的一项对自由活动猕猴进行的睡眠研 与低等哺乳动物不同, 非人灵长类的睡眠与人类的 究中发现, 猕猴 8 小时的睡眠监测过程中, 有 睡眠极为相似(Weitzman et al, 1965)。与人类一样, 89.2%的时间处于睡眠状态, 而在 16 h 的白天监测 非人灵长类动物在夜晚有着稳定的睡眠, 并且在白 过程中, 有约 25.2%的时间处于睡眠状态。猕猴每 天会出现一些小睡。非人灵长类动物中的许多种, 天的睡眠总时间约为 10.5 h, 在整个睡眠过程中, 如狒狒、大狒狒、肯尼亚狒狒、南非小猿猴、猕猴、 REM睡眠, 占23%, NREM-REM周期性活动约60 食蟹猴、派达猴、獴狐猴、黑猩猩等都可以用来研 min 出现一次, 代表睡眠稳定性的脑电δ波的活动 究睡眠, 但通过比较这几种非人灵长类动物的睡眠, 通常在睡眠之后的3~4 h出现, 在睡眠的早期主要 研究者普遍认为黑猩猩(chimpanzee)、狒狒(olive 以深度睡眠如慢波睡眠(NREM睡眠3、4期)为主, baboon)和猕猴(rhesus monkey)是研究非人灵长类 而睡眠晚期主要以 REM 睡眠为主, 这些睡眠特征 和人类之间比较生物学的较好模式动物, 尤其是猕 都与人类睡眠有着极大的相似性, 这些数据进一步 猴, 由于其稳定而完善的睡眠研究系统以及处理和 说明, 猕猴是研究人类睡眠及睡眠的生物学特性的 一种非常好的模式动物(见图3;Hsieh et al, 2008)。 图3 自由活动猕猴24 h慢波睡眠活动及24 h睡眠图 Fig. 3 Slow wave activity over 24 h, and 24 h hypnogram of an unrestrained rhesus monkey 图中上半部分显示的是24 h多导睡眠图整个记录过程中睡眠时相变化, 下半部分显示的是NREM睡眠时的慢波睡眠活动(引自Hsieh et al, 2008, 略有改动)。 The upper part of this figure shows the sleep stages, and the lower part shows slow wave activities during NREM sleep in the 24-h hypnogram (Modified from Hsieh et al, 2008). 88 动 物 学 研 究 32卷 综上所述, 越来越多的研究表明, 非人灵长类 及行为变化, 以阿尔兹海默病(AD)疾病模型为例, 动物的睡眠与人类睡眠模式极为相似, 它是深入研 非人灵长类动物, 尤其是猕猴的 AD 模型, 具有与 究人类睡眠和睡眠病理学的很好的模式动物。 人类一致的神经生物学特性, 是研究 AD 等疾病最 理想的动物模型(Lemere et al, 2004)。 5 非人灵长类动物疾病模型研究与睡眠研 在非人灵长类动物疾病模型建立方面, 我们实 究相结合 验室依托于中国科学院昆明灵长类研究中心及中 建立疾病的动物模型是人类疾病病理研究和 国科学院昆明动物研究所, 拥有雄厚的非人灵长类 药物开发的重要手段。与啮齿类等低等哺乳动物相 实验动物资源。目前为止, 我们已经成功建立起了 比, 非人灵长类动物由于在遗传学、解剖结构和生 猕猴的帕金森氏病疾病模型, PD猴表现出与PD患 理功能上与人类的高度相似性而成为许多精神疾 者相似的临床症状, 如震颤、运动减少、僵直、姿 病模型建立的理想实验动物。首先, 非人灵长类动 势异常等, 在神经病理学方面, 这些猕猴还出现了 物具有与人类相似的大脑结构, 具备高级脑功能, 脑内多巴胺转运体减少、多巴胺神经元死亡等现 可以被训练完成特定类型的测试任务, 对评价认知 象。我们实验室还成功建立了猕猴的抑郁症模型, 能力、情绪反应等具有啮齿类动物无法替代的作用 抑郁猴的行为表现、HPA轴异常等方面都与抑郁病 (Price et al, 1991); 其次, 非人灵长类动物的前额叶 人极为相似。除此之外, 我们实验室在建立猕猴的 皮层和杏仁核与人类一样, 具有调控情感与动机的 AD 模型方面也取得了很大进展。总而言之, 在非 功能(Drevets, 2001), 这使得它们在面对应激刺激 人灵长类动物疾病模型的建立方面, 我们实验室已 时所表现出的反应与人类非常相似, 包括:回避行 经具备了完善的实验条件和实验技术, 建立模型的 为、警觉和觉醒水平的提高、自主神经系统的交感 方法日趋成熟。 神经系统被激活、肾上腺分泌皮质醇等; 再次, 与 在以往的研究非人灵长类动物睡眠的实验中, 脑内五羟色胺系统正常功能密切相关的基因 为了电生理记录的方便, 通常需要把猴子固定在猴 5-HTTLPR(五羟色胺转运体基因启动子区多态性) 椅上, 这样就限制了动物的活动性, 其研究结果必 仅存在于人类和猕猴科动物中( Lesch et al, 1997); 然与动物在自然状态下的真实表现不同。研究表明, 最后, 非人灵长类动物的行为表现与人类非常相似, 身体活动受限的狒狒会出现一定程度的睡眠异常, 同样生活在社会群体中, 具有复杂、高级的认知过 如睡眠−清醒模式被打乱, 不正常的瞌睡和注意力 程, 情感表达(喜、怒、哀、乐)也与人类相似(Barr et 下降等。虽然在猕猴上没有相似的研究, 但有研究 al, 2003; Kalin & Sheltona, 2003)。 表明, 猴椅限制会影响到猕猴的正常行为。为了规 利用非人灵长类动物来建立人类疾病动物模 避这些睡眠研究中的障碍, 我们实验室经过不断地 型已取得重大进展。非人灵长类动物会自发产生一 研究改进, 研究出了一种可以同时记录脑电、肌电、 些与人类相似的疾病, 如老年时期会患上与老年人 眼电等睡眠研究所需参数的记录仪, 该记录仪体积 相似的神经退行性疾病, 像阿尔兹海默病(AD)等, 较小(尺寸5.2 cm×7.7 cm×4.0 cm), 重量较轻, 可 老年猴在认知和记忆测试中的表现较年轻猴差, 老 以通过手术的方式埋植在猕猴的头部, 而且记录仪 年猴脑内还会出现神经元变性、神经元轴突和树突 不会对猕猴的正常活动和生理状态造成影响。与传 异常, 在神经元胞体、近端树突和轴突中还会出现 统的睡眠记录方式相比, 该记录方法具有以下优 淀粉样蛋白沉积, 与老年斑中和血管周围的β淀粉 势:1)睡眠记录仪自带小型的电生理记录和存储设 肽沉积共同存在。老年猴还会出现某些神经递质通 备, 不存在记录线对猕猴自由活动的限制; 2)可以 路的退化, 如基底前脑的乙酰胆碱系统, 这些神经 稳定记录自由活动猕猴每天24 h的清醒−睡眠状态 递质的异常是导致老年动物认知和记忆能力下降 长达半个多月; 3)记录到的数据与用以往方法记录 的因素之一(Price et al, 1991)。除了天然发生的疾病, 到的数据具有可比性, 可以较真实地反映动物的睡 在经过特定的人工诱导, 如药物损伤、转基因、手 眠状态。利用这种方便有效的实验手段, 我们实验 术损伤或自身免疫损伤等方法处理之后, 非人灵长 室已经建立起完备的研究非人灵长类动物睡眠的 类动物可以被诱导出许多与人类疾病相似的病理 实验平台, 可以对猕猴等非人灵长类动物的睡眠进 1期 陈艳梅等:非人灵长类动物模型睡眠研究在神经精神疾病的早期诊断和药效评价中的作用 89 行深入研究。 可以作为疾病严重程度的指标等。因此, 通过在建 立动物疾病模型的过程中同时监测动物的睡眠状 6 小结与展望 况, 我们可以进一步了解随着建模的不断进行, 睡 非人灵长类动物与人类相似的睡眠模式和疾 眠异常是怎样一步步发生的。掌握这一点后, 我们 病发生机理, 使其成为一种理想的动物模型, 可以 就可以通过检测睡眠的正常与否来判断疾病发生 用来研究疾病与睡眠之间的相互关系。我们实验室 的可能性及疾病发展的进程, 这将有助于我们深入 经过多年的探索, 已成功建立了和正在建立猕猴的 研究睡眠作为疾病早期预警因子的原理, 为人类疾 帕金森、老年痴呆、抑郁症等疾病的动物模型; 在 病的早期诊断提供可靠的依据。在出现睡眠异常这 猕猴的睡眠研究方面, 我们也具备了完善的实验条 种疾病早期预警因子之后, 通过合适的手段对疾病 件和实验设备。上文已经提到, 抑郁症、帕金森、 进行早期干预和治疗, 有可能推迟疾病发生的时间 早老性痴呆症等疾病在发病之前都会出现某种程 或把疾病的发生遏制在萌芽状态, 有利于疾病的控 度上的睡眠异常, 睡眠异常是诸多精神性或神经退 制。这项工作, 对于人类精神性和神经退行性疾病 行性疾病发病的早期预警因子, 睡眠异常的程度还 的早期诊断、预防和治疗都具有重要的现实意义。 参考文献: Arnulf I, Leu S, Oudiette D. 2008. Abnormal sleep and sleepiness in Hendler T, Bleich-Cohen M, Sharon H. 2009. Neurofunctional view of Parkinson's disease [J]. Curr Opin Neurol, 21: 472-477. psychiatry: clinical brain imaging revisited [J]. Curr Opin Psychiatry, Asnis GM, Chakraburtty A, DuBoff EA, Krystal A, Londborg PD, 22: 300-305. Rosenberg R, Roth-Schechter B, Scharf MB, Walsh JK. 1999. Hobson JA. 1992. Sleep and dreaming: induction and mediation of REM Zolpidem for persistent insomnia in SSRI-treated depressed patients [J]. sleep by cholinergic mechanisms [J]. Curr Opin Neurobiol, 2: 759-763. J Clin Psychiatry, 60: 668-676. Hoogendijk WJG, van Someren EJW, Mirmiran M, Hofman MA, Lucassen Balzamo E, Santucci V, Seri B, Vuillon-Cacciuttolo G, Bert J. 1977. PJ, Zhou JN, Swaab DF. 1997. Circadian rhythm-related behavioral Nonhuman primates: laboratory animals of choice for neurophysiologic disturbances and structural hypothalamic changes in Alzheimer's studies of sleep [J]. Lab Anim Sci, 27: 879. disease [J]. Int Psychogeriatr, 8: 245-252. Barr CS, Newman TK, Becker ML, Parker CC, Champoux M, Lesch KP, Hsieh KC, Robinson EL, Fuller CA. 2008. Sleep architecture in Goldman D, Suomi SJ, Higley JD. 2003. The utility of the non‐ unrestrained rhesus monkeys (Macaca mulatta) synchronized to human primate model for studying gene by environment interactions in 24-hour light-dark cycles [J]. Sleep, 31: 1239-1250. behavioral research [J]. Genes Brain Behav, 2: 336-340. Iranzo A, Molinuevo JL, Santamaría J, Serradell M, Martí MJ, Valldeoriola Berger M, Riemann D, 1993. REM sleep in depression - an overview [J]. J F, Tolosa E. 2006. Rapid-eye-movement sleep behaviour disorder as an Sleep Res, 2: 211-223. early marker for a neurodegenerative disorder: a descriptive study [J]. Cantero JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B. Lancet Neurol, 5: 572-577. 2003. Sleep-dependent {theta} oscillations in the human hippocampus Jeong J. 2004. EEG dynamics in patients with Alzheimer's disease [J]. Clin and neocortex [J]. J Neurosci, 23: 10897-10903. Neurophysiol, 115: 1490-1505. Chang PP, Ford DE, Mead LA, Cooper-Patrick L, Klag MJ. 1997. Insomnia Kalin N, Sheltona SE. 2003. Nonhuman primate models to study anxiety, in young men and subsequent depression: the Johns Hopkins emotion regulation, and psychopathology [J]. Ann N Y Acad Sci, 1008: Precursors Study [J]. Am J Epidemiol, 146: 105-114. 189-200. Cohrs S, 2008. Sleep disturbances in patients with schizophrenia: impact Kripke DF, Reite ML, Pegram GV, Stephens LM, Lewis OF. 1968. and effect of antipsychotics [J]. CNS drugs, 22: 939-962. Nocturnal sleep in rhesus monkeys [J]. Electroencephalogr Clin Cole MG, Dendukuri N. 2003. Risk factors for depression among elderly Neurophysiol, 24: 581-586. community subjects: a systematic review and meta-analysis [J]. Am J Lemere CA, Beierschmitt A, Iglesias M, Spooner ET, Bloom JK, Leverone Psychiatry, 160: 1147-1156. JF, Zheng JB, Seabrook TJ, Louard D, Li D. 2004. Alzheimer's disease Deadwyler SA, Porrino L, Siegel JM, Hampson RE. 2007. Systemic and A {beta} vaccine reduces central nervous system a {beta} levels in a nasal delivery of orexin-A (Hypocretin-1) reduces the effects of sleep non-human primate, the Caribbean vervet [J]. Am J Pathol, 165: deprivation on cognitive performance in nonhuman primates [J]. J 283-297. Neurosci, 27: 14239-14247. Lesch KP, Meyer J, Glatz K, Flügge G, Hinney A, Hebebrand J, Klauck SM, Diekelmann S, Born J. 2010. The memory function of sleep [J]. Nat Rev Poustka A, Poustka F, Bengel D. 1997. The 5-HT transporter Neurosci, 11: 114-126. gene-linked polymorphic region (5-HTTLPR) in evolutionary Drevets WC. 2001. Neuroimaging and neuropathological studies of perspective: alternative biallelic variation in rhesus monkeys[J]. J depression: implications for the cognitive-emotional features of mood Neural Transm, 104: 1259-1266. disorders [J]. Curr Opin Neurobiol, 11: 240-249. MD CHS, MD MWM, 2002. REM sleep behavior disorder: clinical, Ferrarelli F, Huber R, Peterson MJ, Massimini M, Murphy M, Riedner BA, developmental, and neuroscience perspectives 16 years after its formal Watson A, Bria P, Tononi G. 2007. Reduced sleep spindle activity in identification in SLEEP [J]. Sleep, 25: 120-138. schizophrenia patients [J]. Am J Psychiatry, 164: 483-492. Pace-Schott EF, Hobson JA. 2002. The neurobiology of sleep: genetics, 90 动 物 学 研 究 32卷 cellular physiology and subcortical networks [J]. Nat Rev Neurosci, 3: idiopathic rapid eye movement sleep behavior disorder [J]. Neurology, 591-605. 46: 388-393. Pigeon WR, Hegel M, Unützer J, Fan MY, Sateia MJ, Lyness JM, Phillips C, Sitaram N, Nurnberger Jr JI, Gershon ES, Gillin JC. 1982. Cholinergic Perlis ML, 2008. Is insomnia a perpetuating factor for late-life regulation of mood and REM sleep: potential model and marker of depression in the IMPACT cohort? [J]. Sleep, 31: 481-488. vulnerability to affective disorder [J]. Am J Psychiatry, 139: 571-576. Postuma RB, Lang AE, Massicotte-Marquez J, Montplaisir J. 2006. Tomppo L, Hennah W, Lahermo P, Loukola A, Tuulio-Henriksson A, Potential early markers of Parkinson disease in idiopathic REM sleep Suvisaari J, Partonen T, Ekelund J, nnqvist L, Peltonen L. 2009. behavior disorder [J]. Neurology, 66: 845-851. Association between genes of disrupted in schizophrenia 1 (DISC1) Price DL, Martin LJ, Sisodia SS, Wagster MV, Koo EH, Walker LC, interactors and schizophrenia supports the role of the DISC1 pathway Koliatsos VE, Cork LC. 1991. Aged Non‐Human Primates: An in the etiology of major mental illnesses [J]. Biol Psychiatry, 65: Animal Model of Age‐Associated Neurodegenerative Disease [J]. 1055-1062. Brain Pathol, 1: 287-296. Vazquez J, Baghdoyan HA. 2001. Basal forebrain acetylcholine release Riemann D, Voderholzer U. 2003. Primary insomnia: a risk factor to during REM sleep is significantly greater than during waking [J]. Am J develop depression? [J]. J Affect Disord, 76: 255-259. Physiol Regul Integr Comp Physiol, 280: 598-601. Sabo E, Reynolds CF. 1991. Sleep, depression, and suicide [J]. Psychiatry Vitiello MV, Prinz PN, Williams DE, Frommlet MS, Ries RK. 1990. Sleep Res, 36: 265-277. disturbances in patients with mild-stage Alzheimer's disease [J]. J Sakurai T, Mieda M, Tsujino N. 2010. The orexin system: roles in Gerontol, 45: 131-138. sleep/wake regulation [J]. Ann N Y Acad Sci, 1200: 149-161. Vollrath M, Wicki W, Angst J. 1989. The Zurich study. VIII. Insomnia: Saper CB, Scammell TE, Lu J. 2005. Hypothalamic regulation of sleep and association with depression, anxiety, somatic syndromes, and course of circadian rhythms [J]. Nature, 437: 1257-1263. insomnia [J]. Eur Arch Psychiatry Neurol Sci, 239: 113-124. Sawamura N, Ando T, Maruyama Y, Fujimuro M, Mochizuki H, Honjo K, Weitzman ED, Kripke DF, Pollak C, Dominguez J. 1965. Cyclic activity in Shimoda M, Toda H, Sawamura-Yamamoto T, Makuch LA. 2008. sleep of Macaca mulatta [J]. Arch Neurol, 12: 463-467. Nuclear DISC1 regulates CRE-mediated gene transcription and sleep Wulff K, Gatti S, Wettstein JG, Foster RG. 2010. Sleep and circadian rhythm homeostasis in the fruit fly [J]. Mol Psychiatry, 13: 1138-1148. disruption in psychiatric and neurodegenerative disease [J]. Nat Rev Schenck CH, Bundlie SR, Mahowald MW. 1996. Delayed emergence of a Neurosci, 11: 589-599. parkinsonian disorder in 38% of 29 older men initially diagnosed with
